Ein Molekül wie ein Schweizer Armeemesser

Martin Jinek ist ein Meister der Untertreibung. Angesprochen auf seine unglaubliche Publikationsserie in den besten Fachzeitschriften, meint der Assistenzprofessor am Biochemischen Institut der UZH: «Das passiert schon nicht so oft.» Die Wahrheit ist, dass den meisten Forschungsgruppen nie gelingt, was Jinek und sein Team gerade vorgelegt haben. Vor wenigen Tagen publizierte er eine Arbeit im britischen «Nature», im März 2014 im US-amerikanischen «Science» und kurz davor wiederum im «Nature». Wären wir im Sport, würde man von einem Hattrick sprechen.
Der Grund für diese aussergewöhnliche Serie ist ein zweifacher: Jinek arbeitet auf einem «hot topic», von dem sich die Forschenden weltweit viel versprechen. Sein Forschungsgegenstand – ein Protein namens Cas9 – hat das Potential, die Gentechnik zu revolutionieren. Der zweite Grund liegt in den Kompetenzen Jineks Arbeitsgruppe an der UZH, die im Bereich der Strukturaufklärung von komplexen Molekülen bereits einen internationalen Ruf hat.
Geheimnisvolle Erbgutsequenz
Um die Arbeiten einordnen zu können, ist ein Blick auf die Geschichte dieses Proteins nötig. Forscher haben Cas9 vor wenigen Jahren aus Bakterien isoliert, aber die Anfänge gehen auf ältere Beobachtungen aus den 1980er Jahren zurück. Damals entdeckten japanische Wissenschaftler im Erbgut von Bakterien kurze Abschnitte aus sich wiederholenden Erbgut-Bausteinen (Nukleotiden), die sie als CRISPR bezeichneten (Clustered regularly interspace short palindromic repeats). Lange Zeit blieb die Funktion dieser Abschnitte im Dunkeln, bis im Jahre 2005 mehrere Arbeitsgruppen ihre Übereinstimmung mit Teilen aus dem Erbgut parasitärer Viren erkannten.
Nachfolgende Experimente bestätigten die Vermutung, dass die CRISPR-Abschnitte Teil eines Erkennungssystems sind, mit dem Bakterien schädliche Viren identifizieren. Diese Erkennung ist das Vorspiel der Abwehr. Und beim nachfolgenden Schritt übernimmt Cas9 die Regie. Mithilfe eines aus der CRISPR-Sequenz abgeleiteten Moleküls (RNA) wird das Protein zur eindringenden Virus-DNA geführt und schneidet diese in Stücke. Cas9 steht für CRISPR assoziiertes Protein Nummer 9. «Das Molekül Cas9 ist eine vielseitig nutzbare Schere, die DNA schneiden kann», sagt Martin Jinek.
Am richtigen Ort
Die Entdeckung elektrisierte die Fachwelt, weil erstmals klar wurde, dass die als einfach betrachteten Einzeller ein hochkomplexes Immunsystem aufweisen. Der damals 28jährige Biochemiker war zur richtigen Zeit am richtigen Ort, als diese bahnbrechenden Erkenntnisse die Runde machten. 2007 arbeitete Martin Jinek als Post-Doc im Labor von Jennifer Doudna an der University of California in Berkeley, wo er sich mit CRISPR und Cas9 beschäftigte.
Weil er sich schon immer für räumliche Strukturen von Proteinen und Erbgutmolekülen interessiert hatte, stürzte sich Jinek auf das Molekül, um dessen Funktionsweise zu entschlüsseln. So stieg der Forscher in ein Gebiet ein, das ihm und seiner Gruppe eine Publikation nach der anderen eingebracht hat.
So funktioniert das Abwehrsystem
Martin Jinek arbeitet mit seinem Team daran, die Funktionsweise des Proteins auf der molekularen Ebene zu verstehen. In der neusten Publikation, die auf den Arbeiten der Doktorierenden Carolin Anders und Ole Niewöhner sowie der Labor-Managerin Alessia Dürst beruht, geht es um atomare Details im Erkennungsprozess zwischen der DNA und dem schneidenden Protein. «Wir konnten zeigen, wieso einzelne Nukleotide nötig sind, damit die DNA geschnitten wird», sagt Carolin Anders.
Für den Befund nötig waren knifflige Experimente, bei denen die Doktorandin Varianten von Cas9 in mikroskopisch kleine Festkörper kristallisieren musste. Die Kristalle durchleuchtete sie danach mit Röntgenstrahlen. Diese Untersuchungen liefern ein räumliches Bild des Moleküls und seiner Atome. Sie sind einer Landkarte vergleichbar, aus der die Funktionsweise der verschiedenen Molekülbereiche abgeleitet werden kann.
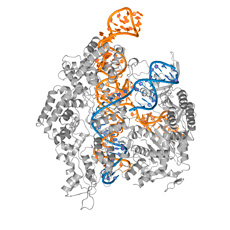
Die Kristallisation komplexer Proteine wie Cas9 braucht viel Know-how und Fingerspitzengefühl. Zum Erfolg beigetragen haben das Protein Crystallization Center des Biochemischen Instituts der UZH sowie das Paul Scherrer Institut in Villigen (AG), das mit dem SLS (Synchotron Light Source) den Forschern eine extrem starke Röntgenstrahlquelle zur Verfügung stellt. Sie ermöglicht die Analyse kleiner Proteinkristalle. Dies beschleunigt die Experimente und erhöht die Produktivität, was sich in der erstaunlichen Publikationsserie niederschlägt.
Neues Kapitel der Gentechnik
Das UZH-Team von Martin Jinek und seinen Mitarbeitern betreibt mit den Strukturanalysen reine Grundlagenforschung. Die daraus gewonnenen Erkenntnisse sind für Spezialisten spannend, sie stossen aber nicht nur deswegen auf grosse Resonanz in den besten Fachzeitschriften, sondern auch weil sich mit Cas9 eine Umwälzung in der Gentechnik anbahnt. «Das Molekül ist das Werkzeug der Zukunft, um Erbgutmoleküle hochpräzise zu verändern», sagt Ole Niewöhner. Denn es erlaubt in einem Arbeitsschritt mehrfache und gezielte Änderungen an zu untersuchenden Organismen und ihrer DNA.
Cas9 gilt als zukunftsträchtiges Arbeitsmittel in der Forschung und der Gentherapie, zum Beispiel im Bereich der Stammzellen-Forschung. Eine Vielzahl von Gruppen setzt es bereits ein, zum Beispiel der Entwicklungsbiologe Christian Mosimann von der UZH. Im Fachblatt «Science» wurde Cas9 aufgrund seiner Vielseitigkeit auch schon mit einem Schweizer Armeemesser verglichen.
Martin Jinek legt Grundlagen für diese Anwendungen. Der Assistenzprofessor aus Tschechien, der letztes Jahr an die UZH berufen wurde, will in erster Linie die Funktionsweise des zukunftsträchtigen Proteins verstehen. Dass Jinek und sein Team viel Potential haben, hat auch der Europäische Forschungsrat (ERC) erkannt und ihm 2013 für seine Arbeiten 1.5 Millionen Euro zugesichert. Mit dem Geld wird der Biochemiker die Arbeiten vorantreiben, ein nächster Schritt ist der Vergleich verschiedener Vertreter aus der Cas9-Familie aus unterschiedlichen Bakterien.
Zum ERC-Grant sagt Martin Jinek nicht viel, seinem Understatement bleibt er treu: «Dank dem Grant können wir uns in Ruhe auf die Forschung konzentrieren, Ziel ist, kompetitiv zu bleiben.»