Den Feind kennen wie sich selbst
Schwindelerregend ist es und auch etwas eklig: Die Tatsache, dass wir Menschen zehnmal mehr Bakterien als eigene Körperzellen besitzen. Die Bakterien verteilen sich hauptsächlich im Darm, auf der Haut und auf den Oberflächen der Atemwege und wiegen mehr als 1,5 Kilogramm. Doch ohne sie wären wir nichts, denn die meisten dieser Bakterien helfen uns, zum Beispiel bei der Verdauung. Zudem dienen diese «guten» Bakterien als Platzhalter, verdrängen die «bösen» Bakterien und verhindern so, dass letztere uns krank machen.
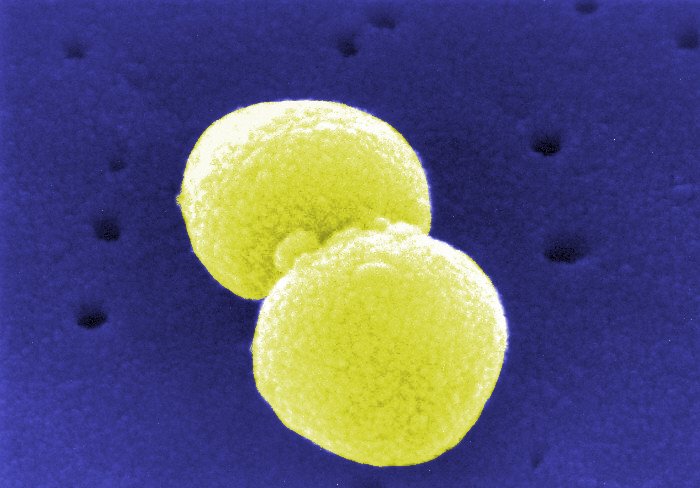
Beim gesunden Menschen besteht ein Gleichgewicht zwischen den «bösen», krankmachenden Bakterien, den «guten», nützlichen Bakterien und der eigenen Körperabwehr. Ist unsere Körperabwehr aber geschwächt oder sind die nützlichen Bakterien stark reduziert, ist dieses Gleichgewicht gestört. In der Folge können wir den krankmachenden Bakterien nicht genügend entgegenwirken und erkranken.
Mit Antibiotika töten wir gefährliche Bakterien ab, und alles ist wieder gut. Nur, ganz so einfach ist es nicht. Der Einsatz von Antibiotika erweist sich oft als problematisch. Denn auch die nützlichen Bakterien werden dabei getötet. Das Gleichgewicht gerät abermals aus dem Lot, was vor allem bei Patienten mit ohnehin geschwächtem Immunsystem (Krebskranke, Organtransplantierte, ältere Menschen, HIV-Patienten) zu Folgeerkrankungen wie Pilzinfektionen führen kann. Zudem haben viele krankmachenden Bakterienarten gelernt, mit Antibiotika umzugehen und sind dagegen resistent.
«Gruppe A Streptokokken» im Fokus
Alternativen zu Antibiotika, die ganz gezielt nur krankmachende Bakterien vernichten, sind also gefragt. Doch dazu muss man die gefährlichen Bakterien erst besser kennen. Meistens ist unklar, warum genau eine bestimmte Bakterienart krank macht, während andere dies nicht können.
Genau diese Fragen interessieren Annelies Zinkernagel (38), Oberärztin und Laborgruppenleiterin an der Klinik für Infektionskrankheiten und Spitalhygiene des Universitätsspitals Zürich. «Wenn wir wissen, welche Faktoren dafür verantwortlich sind, dass ein bestimmtes Bakterium krank macht, können wir ganz gezielt Medikamente entwickeln, die diese Faktoren ausschalten», erklärt Zinkernagel.

Im Zentrum Ihrer Forschung stehen die «Gruppe A Streptokokken». Diese sind medizinisch äusserst relevant: Sie können zu rheumatischem Fieber führen, verursachen weltweit pro Jahr über 700 Millionen Rachenentzündungen, mehr als 650'000 invasive Infektionen wie die gefürchtete nekrotisierende Fasziitis und sind für 150'000 Todesfälle verantwortlich.
Oberflächenprotein bestimmt Gefährlichkeit
Bei «Gruppe A Streptokokken» weiss man, dass ein bestimmtes Oberflächenprotein, das sogenannte M-Protein, für die Gefährlichkeit des Bakteriums eine wesentliche Rolle spielt. Dieses M-Protein kommt in vielen Varianten vor. Allerdings sind nur einige Varianten in der Lage, Krankheit zu vermitteln, allen voran der «Serotyp M1». Dieses M1-Protein trickst unsere allererste, unspezifische Abwehr aus. Es bewirkt, dass das Bakterium überhaupt in die Zellen und von dort ins Blut gelangen kann.
Im Blut selber bindet das M1-Protein den Blutgerinnungsstoff Fibrinogen an sich und bewirkt, dass die ganze Bakterienoberfläche von Fibrinogen zugedeckt wird. Auf diese Weise kann das Bakterium den im Blut aktiven Fresszellen ausweichen. Bis jetzt war es nicht möglich, einen Impfstoff gegen «Gruppe A Streptokokken» zu entwickeln. Die Antikörper auf das M-Protein erkennen nämlich gleichzeitig die körpereigenen Zellen, weshalb es auch zu rheumatischen Fieber kommen kann.
Verändertes M1-Protein
Annelies Zinkernagel verbrachte fast fünf Jahre als Postdoktorandin an der Division of Pediatric Infectious Diseases der University of California in San Diego und hat dort das Krankheitspotenzial von Streptokokken und Staphylokokken erforscht. Die Arbeitsgruppe konnte dabei zeigen, dass die Struktur des M1-Proteins sehr unregelmässig ist.
In der Arbeitsgruppe wunderte man sich, weshalb die Natur ein so unperfektes Ding herstellt und veränderte das Protein so, dass es neu eine regelmässige Struktur aufweist. «Es gibt Hinweise darauf, dass dieses idealisierte M1-Protein das Bakterium viel weniger gefährlich macht als das ursprüngliche M1-Protein. Dies genauer zu untersuchen ist das Ziel meiner jetzigen Forschung», erläutert Zinkernagel.
Dazu vergleicht sie ursprüngliche Streptokokken, Streptokokken mit dem veränderten M1-Protein sowie Streptokokken, denen das M1-Protein fehlt, in bezug auf ihre Fähigkeit, in Körperzellen einzudringen und Fibrinogen an sich zu binden. Als Kontrolle dient das völlig harmlose Bakterium, Lactococcus lactis. Auch dieses wird in drei Formen, der ursprünglichen Version ohne M1-Protein, mit eingepflanztem, gefährlichem M1-Protein sowie mit dem veränderten, idealisierten M1-Protein, verwendet. Die in vitro-Versuche werden danach auf in vivo-Versuche erweitert.
Forschung und Praxis kombiniert
Künftig möchte Annelies Zinkernagel das M1-Protein noch genauer analysieren. Ihr Ziel ist es, herauszufinden, welche Komponenten für das Krankheitspotenzial von Streptokokken relevant sind. Dabei kommt ihr entgegen, dass sich Forschung und klinische Tätigkeit ideal ergänzen, auch wenn die Summe der beiden Teilzeitpensen von je 50 Prozent deutlich über einer Vollzeitstelle liegt.
Für Zinkernagel, Mutter von zwei Kindern, lohnt sich der Effort dennoch: «Die Grundlagenforschung, die ich neben der Klinik mache, hilft mir zu verstehen, was dort wirklich vor sich geht, warum gewisse Medikamente wirken und welche Nebenwirkungen zu erwarten sind. Die Erfahrungen aus dem Spital fliessen direkt in meine Forschungen ein und umgekehrt.»
Als Beispiel nennt sie die nekrotisierende Fasziitis, eine schwere Infektion der Weichteile, die ebenfalls durch Streptokokken hervorgerufen wird. Normalerweise tritt bei einer bakteriellen Infektion sofort der Botenstoff IL-8 auf, der seinerseits die Fresszellen anlockt, die den Bakterien zu Leibe rücken. In der Klinik wurde nachgewiesen, dass bei der nekrotisierenden Fasziitis kein IL-8 im Gewebe auffindbar ist. Stattdessen ist eine bakterielle IL-8-Protease aktiv, welche die IL-8 zerstört. «Mit diesem Wissen können wir anfangen, im Labor gezielt nach Wegen zu suchen, um die IL-8-Protease zu hemmen», so Zinkernagel.
Den Blick auf die Zukunft gerichtet
«Zürich ist ein optimaler Forschungsstandort», hält Zinkernagel fest. «Die Nähe zum Universitätsspital und zu Labors an der Universität und an der ETH sind optimal. Zudem gibt es viele Möglichkeiten, um finanzielle Unterstützung zu erhalten.»
An der Universität Zürich Irchel baut Zinkernagel aktuell ein eigenes Labor auf, und die finanzielle Unterstützung für die Folgeprojekte ihrer Forschung ist auch bereits eingeleitet. Sie wird unterstützt von der Stiftung für Forschung an der Universität Zürch und erhielt für ihre Arbeit in der Entwicklung neuer Therapien bei bakteriellen Infektionen kürzlich den «Wissenschaftspreis 2010 der Walter und Gertrud Siegenthaler Stiftung».