An den Schaltstellen der Nervenzellen
Die Ursachen von Krankheiten in Muskeln und Nervensystem können wir nur durch Grundlagenforschung erklären. Die Arbeit der Forschungsgruppe von Raimund Dutzler steht in diesem Rahmen, denn sie untersucht die Strukturen von Zellmembran-Proteinen. Ionenkanäle gehören zu den Membranproteinen, welche die elektrische Aktivität in Nerven- und Muskelzellen steuern. Damit diese komplexen Vorgänge funktionieren, müssen sich Ionenkanäle kontrolliert öffnen und schliessen, um so den Fluss von bestimmten Ionen durch die Zellmembran zu ermöglichen. In ihrer Arbeit versuchen die Wissenschaftler einen grundlegenden molekularen Einblick zu gewinnen, wie die dreidimensionale Struktur einer bestimmten Familie von Ionenkanälen, den Neurotransmitter-Rezeptoren, in verschiedenen Zuständen aussieht.
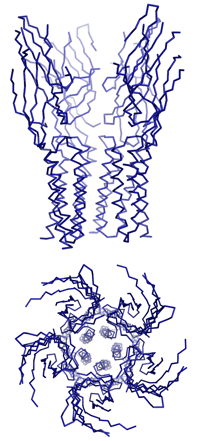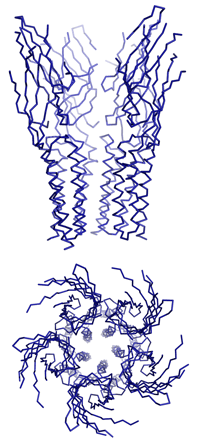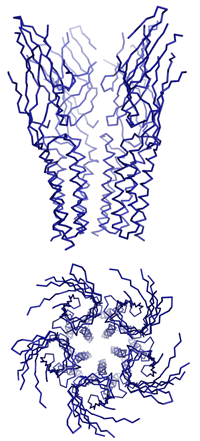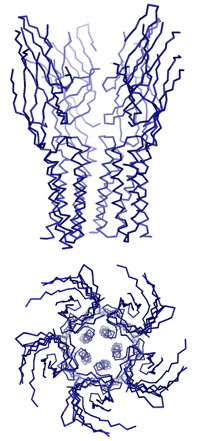
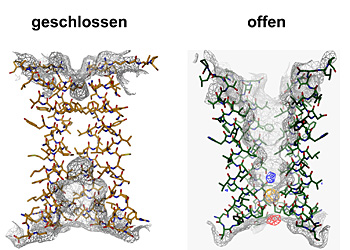
Dazu isolierten Dutzler und Hilf nahe bakterielle Verwandte dieser speziellen Gruppe von Ionenkanälen, die für den Transport von positiv geladenen Ionen durch die Membran zuständig sind. Durch anschliessende Kristallisation ist es ihnen gelungen, die dreidimensionale Struktur und den Öffnungsmechanismus der Neurotransmitter-Rezeptoren zu entschlüsseln. «Um die Funktionsweise dieser Ionenkanäle zu verstehen, müssen wir ihre dreidimensionalen Strukturen im geschlossenen sowie im offenen Zustand kennen», erklärt Professor Raimund Dutzler. Vor acht Monaten stellten er und seine Arbeitsgruppe am Biochemischen Institut der Universität Zürich die erste detaillierte Struktur eines geschlossenen Rezeptors vor.
Einer aufblühenden Knospe ähnlich
Nun ist es der Gruppe gelungen, die Struktur eines verwandten Ionenkanals im offenen Zustand mit Hilfe der Röntgenstrukturanalyse aufzuklären. «Es war bisher nicht möglich, anhand der bekannten dreidimensionalen Struktur den Mechanismus des Öffnens und des selektiven Ionenflusses zu ermitteln. In Kombination mit der neuen Struktur beginnen wir diesen Prozess zu verstehen», erläutert der Strukturbiologe.
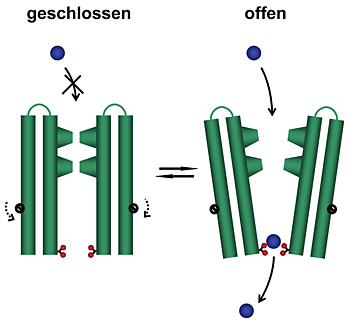
«Das Ergebnis der Untersuchung ist unerwartet und überraschend», so Dutzler. «Es zeigt einen Öffnungsmechanismus, der dem traditionellen Bild dieses Prozesses widerspricht, denn zuvor hat man sich die Bewegung eher wie das Drehen einer Helix um ihre Achse vorgestellt.» Beim Öffnen bewegen sich jedoch die Teile des Proteins, die den Kanal bilden, als Einheit. Da das Protein aus fünf identischen Untereinheiten besteht, die die gleichen Bewegungen ausführen, öffnet sich der Kanal ähnlich einer aufblühenden Knospe. Die Bewegungsabläufe sind dabei umfangreicher und komplizierter als erwartet.
Dass die neuen Erkenntnisse langfristig auch Auswirkungen auf die Entwicklung neuer Medikamente haben, davon ist Dutzler überzeugt. «Wir untersuchen Modellsysteme, die auch für den Menschen relevant sind. Allerdings ist der Weg vom Labor bis in die Apotheke noch lang».
Die Arbeit von Raimund Dutzler und seiner Doktorandin Ricarda Hilf wurde im Rahmen des «National Center of Competence in Research, Structural Biology» durchgeführt. Die Ergebnisse erscheinen in der Online-Ausgabe des Wissenschaftsmagazins «Nature».