Türhüter der Zellkommunikation

Die in der Online-Ausgabe der Zeitschrift «Nature» publizierte Untersuchung liefert damit erstmals eine detaillierte Struktur von so genannten ligandengesteuerten Ionenkanälen oder Neurotransmitter-Rezeptoren. Über diese wichtige Proteinklasse wird die elektrische Signalübertragung in Nervenzellen gesteuert.
Die ligandengesteuerten Ionenkanäle befinden sich in den Zellmembranen und reagieren auf die Bindung eines Botenstoffes (Ligand). Jeder Rezeptor bindet einen spezifischen Liganden und lässt daraufhin entweder Natrium- oder Chlorid-Ionen in eine Zelle hinein. Dadurch entstehen elektrische Signale, welche die Grundlage für Nervenreizleitungen bilden. Die Ionenkanäle sind wichtige Angriffspunkte für Medikamente. Funktionieren sie fehlerhaft, können sie zudem neurologische Krankheiten wie etwa Epilepsie verursachen.
Im Modellorganismus isolieren
Wie diese Ionenkanäle genau aufgebaut sind, war bisher allerdings nicht bekannt. Dutzler und Hilf haben deshalb eine komplexe Methode verwendet, um Antworten zu finden. Sie bauten die für derartige Proteine kodierende DNA in einen bakteriellen Modellorganismus ein.
So war es möglich, die Proteine herzustellen, sie zu isolieren und kristallisieren zu lassen, um sie damit in eine geordnete Form zu bringen. Diese Proteinkristalle beschossen sie anschliessend mittels einer speziellen Apparatur am Paul Scherrer Institut mit Röntgenstrahlen, um ihren Aufbau sichtbar zu machen.
Dabei zeigte sich ein Protein, welches sehr ähnlich aufgebaut ist wie die humanen Rezeptoren. Der Ionenkanal wird aus fünf Proteinketten gebildet und besteht aus zwei Teilen: der Andockungsstelle, die aus der Zellmembran hinausragt und einem engen Kanal, der in der Membran sitzt und den Ionenfluss reguliert.
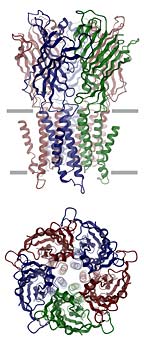
Den Kanal öffnen
Die Röntgenstrukturanalyse zeigt aber auch den detaillierten Aufbau der Aminosäuren. «Die nun sichtbare Struktur bildet den ersten, wichtigen Teil eines Puzzles», so Dutzler. Die untersuchten Proteine wurden in einem Zustand kristallisiert, als der Kanal für den Durchfluss von Ionen geschlossen war. Entsprechend fehlt jetzt noch das Gegenstück, die Struktur des offenen Kanals.
Zudem wollen Dutzler und Hilf in ihrer weiteren Forschung diejenigen Moleküle finden, welche an den Rezeptor binden und damit die Öffnung des Ionenkanals bewirken – den so genannten Liganden. «Wir wollen mit unserer Grundlagenforschung zu einem umfassenden Bild eines wichtigen physiologischen Prozesses beitragen. Dies wird schlussendlich auch die Entwicklung neuer Medikamente ermöglichen», so Dutzler.