Navigation auf uzh.ch
Navigation auf uzh.ch
Erkältungskrankheiten, Fieberbläschen, Hepatitis, AIDS: Verursacher dieser und vieler anderer Krankheiten sind Viren: kleinste infektiöse Partikel, die einzig aus Erbmaterial (DNA oder RNA) und einer Proteinhülle bestehen. Viren besitzen keinen eigenen Stoffwechsel. Um sich zu vermehren, benötigen sie eine lebende Wirtszelle – je nach Virus eine Menschen-, Tier-, Pflanzen- oder Bakterienzelle. Gelingt es dem Virus, in eine Zelle einzudringen, setzt es dort sein Erbgut frei. Dieses zwingt die Wirtszelle, in grosser Zahl Virusbestandteile zu produzieren und diese zu neuen Viren zusammenzubauen. Danach stirbt die Wirtszelle in der Regel ab, und die neuen Viren werden freigesetzt.

Weil Viren keine Zellen sind und keinen eigenen Stoffwechsel besitzen, ist die Entwicklung antiviraler Medikamente schwierig. Viren können nicht wie Bakterien mit Antibiotika abgetötet werden. Ein Wirkstoff, mit dem Viren bekämpft werden können, muss entweder ihr Eindringen in die Wirtszelle verhindern, die Vermehrung in der Zelle stoppen, oder die Freisetzung neuer Viren unterbinden.
Um dem Patienten nicht zu schaden, muss das Arzneimittel zudem gezielt auf das Virus einwirken und darf nicht die Wirtszellen angreifen. Die Entwicklung eines solchen Medikamentes bedingt detaillierte Kenntnisse über den Ablauf einer Virusinfektion und darüber, was mit der DNA des Virus in der Wirtszelle geschieht. Anne Neef, die im Labor von Professor Nathan Luedtke am Institut für Organische Chemie forscht und durch den Forschungskredit gefördert wird, arbeitet an einem wichtigen Werkzeug zur Aufklärung dieser komplexen Prozesse.
Damit der Weg einzelner Viren in der Wirtszelle verfolgt werden kann, muss man deren DNA sichtbar machen können, zum Beispiel durch Markieren mit einem Fluoreszenzfarbstoff. Der Farbstoff darf dabei nur die virale DNA markieren, damit diese von der DNA der Wirtszelle unterschieden werden kann. «Bisher kennt man aber keine Möglichkeit, in einer infizierten Wirtszelle selektiv nur die Viren-DNA chemisch zu markieren», erzählt Anne Neef.
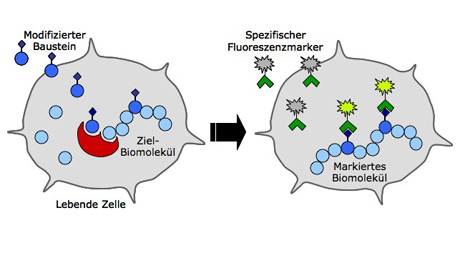
Neef versucht nun, das Problem mit einer Methode zu lösen, die Forscher seit einigen Jahren anwenden, um Biomoleküle in ihrer natürlichen Umgebung in Zellen und Organismen zu markieren. Soll beispielsweise die DNA markiert werden, inkubiert man Zellen mit einem Nukleosid (einem Baustein der DNA), welches eine spezielle chemische Gruppe, die als «chemischer Reporter» bezeichnet wird, enthält. Bei der Vervielfältigung der DNA bauen die Zellen dieses spezielle Nukleosid in die DNA ein. Später wird zur Zellkultur ein Stoff zugegeben, der mit dem chemischen Reporter reagiert. Diese Reaktion lässt die DNA fluoreszieren, so dass unter dem Mikroskop beobachtet werden kann, zu welchem Zeitpunkt die DNA sich an welchem Ort in der Zelle befindet.
In einem ersten Schritt hat Anne Neef eine Reihe von abgewandelten Nukleosiden – sogenannte Nukleosid-Analoga – synthetisiert. Sie hat die Nukleoside so verändert, dass sie als chemische Reporter für die Markierung von Viren-DNA verwendet werden können. Allzu grosse Änderungen durfte sie dabei aber nicht einfügen, weil die Nukleoside sonst nicht mehr erkannt und in die DNA eingebaut werden.
Mit verschiedenen Tests hat sie danach überprüft, ob sich die hergestellten Nukleosid-Analoga für die vorgesehene Methode eignen: Ist die Verbindung nichttoxisch für die Wirtszelle? Hemmt sie nicht die Vervielfältigung der Viren-DNA? Und schliesslich: Wird sie in die virale, aber nicht in die DNA der Wirtszelle eingebaut? «Leider hat bisher keines der getesteten Nukleosid-Analoga alle drei Kriterien erfüllt», bedauert Neef. Zurzeit ist sie dabei, weitere Nukleoside zu synthetisieren.
Einen Erfolg konnte Anne Neef trotzdem schon verbuchen: Eines der getesteten Nukleosid-Analoga ist, im Gegensatz zu bisher publizierten Verbindungen, nicht toxisch für die Wirtszellen. Zwar wird auch dieses Nukleosid sowohl in die virale als auch in die Wirtszell-DNA eingebaut und kann deshalb nicht verwendet werden, um spezifisch das virale Erbgut zu markieren, wenn sich dieses bereits in der Wirtszelle befindet. Es ermöglicht aber, markierte Viren zu produzieren. Wenn diese aus der Zelle isoliert und aufgereinigt werden, kann man sie für die Infektion frischer Wirtszellen verwenden, in denen dann die virale DNA verfolgt werden kann. Weil die Verbindung für die Wirtszellen nicht toxisch ist, eignet sich das Nukleosid für Experimente, in denen über einen längeren Zeitraum untersucht wird, was mit der markierten Viren-DNA nach der Infektion in der Zelle passiert.