Navigation auf uzh.ch
Navigation auf uzh.ch
Der menschliche Organismus besteht aus Abermilliarden Zellen und in jeder einzelnen menschlichen Zelle befinden sich circa 20’000 bis 25’000 Gene. Der Zellkern jeder Körperzelle enthält damit die gesamte Erbinformation, unser Genom. Kommt es zur Zellteilung, wird die DNA des Zellkerns einmal komplett dupliziert. Erstaunlicherweise ist die Kopie fast immer perfekt – fast, aber eben nicht immer. Es kann vorkommen, dass dabei Fehler entstehen, oder dass sogar die DNA auseinander bricht. Dies kann massive Auswirkungen haben, und es kann zu unkontrolliertem Zellwachstum kommen, das im schlimmsten Fall auch Krebs auslösen kann.
Doch häufig kommt es erst gar nicht soweit. Die Zellen selbst haben eine Strategie entwickelt: Sie können Schäden an der DNA erkennen und eliminieren. Wie Zellen Fehler erkennen, erforscht Molekularbiologe und SNF-Föderungsprofessor Matthias Altmeyer. Zusammen mit seinem Team untersucht er die Struktur, quasi die innere Architektur der Zellen und ihre Funktionsweise. «Dem Verständnis, wie Zellen arbeiten, sind wir ein Stückchen näher gekommen», sagt Altmeyer, der gemeinsam mit dänischen Forschern seine jüngsten Forschungsergebnisse Ende August in «Nature Communications» veröffentlichte.
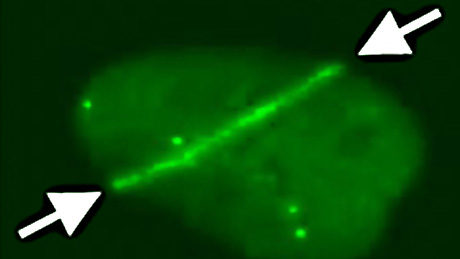
Die Forschenden arbeiten mit lebenden Zellen. Mittels eines UV-Lasergeräts werden ihnen Schäden an der Erbsubstanz zugefügt. Was dann geschieht, können die Forschenden unter dem Mikroskop in Live-Zell-Experimenten beobachten. Erkennt die Zelle einen Schaden, teilt sie den Raum in Subkompartimente auf. «Es werden dadurch temporäre Baustellen geschaffen, die im Schnellverfahren von anderen Bereichen in der Zelle abgetrennt werden. In jeder dieser Baustellen spielen sich spezifische biochemische Reaktionen ab», sagt Altmeyer. Diese biochemischen Aufräumprozesse dauern nicht länger als fünf bis zehn Minuten.

Aktiv beteiligt am Aufräumen in der Zelle ist ein Protein. Genauer gesagt das Enzym PARP1 (Poly(ADP-Ribose)-Polymerase 1). PARP1 wird aktiviert, sobald die Zelle einen DNA-Schaden erkennt. Das Enzym bildet an der Schadensstelle ein kettenartiges Molekül, das als Nukleationskeim für die lokale Akkumulation weiterer Proteine fungiert. «Es ist so, als wenn der Aufseher an einer Baustelle eine Gefahrenstelle erkennt und isoliert. Auf diese Weise wird verhindert, dass der ganze Bau in Mitleidenschaft gezogen wird», erklärt Altmeyer. Die Proteinansammlung wirkt dabei wie eine räumliche Barriere. Nukleationskeime sind ein bekanntes physikalisches Phänomen, das zum Beispiel auch bei gefrierendem Wasser wirkt. Auch Wasser braucht einen Ansatzpunkt, an dem die Eiskristalle zu wachsen beginnen. Zum Beispiel ein Staubkorn oder ein Bakterium.
Altmeyer konnte nun nachweisen, wie die Proteine die räumliche Trennung der beschädigten Stellen in der menschlichen Zelle bewerkstelligen: Sie bilden temporär ein neues Zellkompartiment, das die beschädigte Stelle einkapselt, so dass sie sich nicht zerstörerisch auf den Gesamtorganismus auswirken kann.
Interessant für die Forschenden war die Beobachtung, dass diese Kompartimente nur für sehr kurze Zeit eingerichtet, und dass sie wieder aufgelöst werden, sobald die Arbeit getan ist. «Es ist ein enorm dynamischer Prozess», beschreibt Altmeyer das Geschehen. «Die Zelle möchte unter allen Umständen vermeiden, dass sich feste Aggregate bilden, die sich nicht wieder auflösen lassen».
Noch ist nicht geklärt, wie die Zelle die abgetrennten Bereiche bei der DNA Reparatur wieder auflöst. «Wir untersuchen jetzt die zellulären Mechanismen, die diese Dynamik bewirken und die verhindern, dass die lokalen Ansammlungen an Schadensstellen zu intrazellulären festen Aggregaten führt», sagt Altmeyer.