Navigation auf uzh.ch
Navigation auf uzh.ch
Jede einzelne Zelle unseres Körpers birgt Erbinformation in Form von Desoxyribonukleinsäure, oder kurz DNA, in sich. Dieses Biomolekül enthält unsere Gene und besteht im wesentlichen aus den vier Bausteinen Adenin, Cytosin, Guanin und Thymin. In jedem Gen ist die Reihenfolge dieser vier sogenannten Basen anders. Diese Basen-Abfolge bestimmt, in welches Protein ein Gen übersetzt wird.
Die Gruppenleiterin Raffaella Santoro vom Institut für Veterinärbiochemie und Molekularbiologie der Universität Zürich vergleicht die DNA mit einem Kochbuch: «Jeder Mensch hat ein eigenes, ganz individuelles Kochbuch, das in jeder Zelle enthalten ist. Die Rezepte im Kochbuch sind die Gene. Aber nicht in allen Zellen wird dasselbe Menu gekocht.» Mit anderen Worten: In jeder Zelle sind andere Gene an- oder abgeschaltet. Daher werden je nach Zelle andere Gene in Proteine übersetzt. Eine Zelle der Lunge enthält ganz andere Proteine, als eine Hirnzelle.
Es ist schon längere Zeit bekannt, welche Faktoren bestimmen, was gekocht wird und was nicht. Es sind sogenannte epigenetische Markierungen, die Gene an- und abschalten. Diese Markierungen bestehen aus chemischen Verbindungen, die an die DNA binden. Je nach Ort und Eigenschaft dieser Verbindungen ist ein Gen an- oder abgeschaltet.
Wenn sich nun eine Zelle beispielweise während der Wundheilung verdoppelt, wird die DNA exakt kopiert – nicht aber die epigenetischen Markierungen. Diese müssen nach dem Kopiervorgang erst wieder angefügt werden. «Eine neugeborene Zelle muss also wissen, welche Markierung an welche Stelle gehört», sagt die Biochemikerin Santoro.
Santoro und ihr Team haben einen Mechanismus entdeckt, wie die epigenetischen Markierungen nach der Zellverdoppelung wieder an Ort und Stelle kommen. Eine zentrale Rolle spielt dabei die sogenannte Ribonukleinsäure (RNA).
Die RNA entsteht als Zwischenstufe bei der Übersetzung eines Gens in das entsprechende Protein. Es gibt aber auch spezielle RNA-Moleküle, die nicht an der Proteinherstellung beteiligt sind. «Diese RNA-Moleküle wurden als Abfall abgetan – zu Unrecht, wie wir jetzt wissen», sagt Santoro. Denn: Genau diese RNA-Moleküle spielen eine zentrale Rolle beim Vorgang der epigenetischen Markierungen nach der Zellverdoppelung.
Diese RNA interagiert in einem komplexen Zusammenspiel mit anderen Faktoren. Dabei entsteht ein Signal, das den epigenetischen Markierungen den Weg weist. Es zeigt der neugeborenen Zelle, wo und mit welcher Verbindung die DNA markiert werden soll.
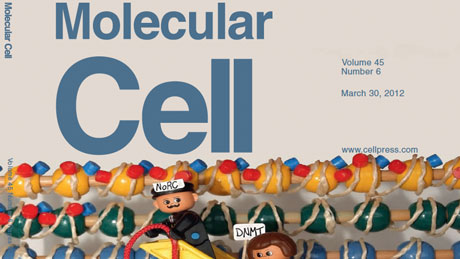
Diesen neu entschlüsselten Mechanismus hat Santoro in der aktuellen Ausgabe der renommierten Fachzeitschrift «Molecular Cell» publiziert und landete damit sogar auf dem Titelblatt.
Die epigenetischen Markierungen sind von entscheidender Bedeutung. Sind nämlich die falschen Gene an- oder abgeschaltet, kann aus einer gesunden Zelle eine Krebszelle werden. Es gibt bereits marktreife Krebsmedikamente – beispielsweise gegen Leukämie – die ein krebshemmendes Gen aktivieren, das aufgrund von fehlerhaften epigenetischen Markierungen ausgeschaltet ist. «Unsere Studie ist ein weiterer Mosaikstein im Kampf gegen Krebs», sagt Santoro.