Navigation auf uzh.ch
Navigation auf uzh.ch
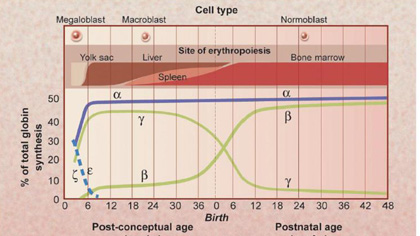
Ein Baby kommt auf die Welt. Und schlagartig muss sich der kleine Körper auf die veränderten Lebensbedingungen umstellen. Dies betrifft auch das Hämoglobin, das in den roten Blutkörperchen den Sauerstoff transportiert. Das vorgeburtliche fötale Hämoglobin, das sogenannte HbF, wird bis Ende des ersten Lebensjahres durch eine «erwachsene» Form, das HbA, ersetzt.

Für die meisten Menschen läuft dies unbemerkt und ohne grössere Nebenwirkungen ab. Ganz anders für Menschen mit Thalassämie oder Sichelzellanämie. Bei diesen Erbkrankheiten ist die Bildung des Hämoglobins gestört. Wichtigstes Symptom ist eine schwere Anämie, die zu erheblichen Nebenwirkungen wie zum Beispiel Organschäden führt.
Vorgeburtliches Hämoglobin lindert Symptome
Wenn das vorgeburtliche Hämoglobin dem erwachsenen Hämoglobin weicht, verschlimmern sich oft die Symptome der Blutkrankheit. Manche Kinder werden so krank, dass sie regelmässig Transfusionen oder Medikamente benötigen. Andererseits gibt es auch Menschen, die aus ungeklärten Gründen das vorgeburtliche Hämoglobin beibehalten und im Falle einer angeborenen Thalassämie oder Sichelzellanämie fast symptomlos sind.
In der Regel gilt: Je höher der Anteil des HbF, desto besser geht es den Patienten. Thalassämie und Sichelzellanämie treten gehäuft im Mittelmeerraum beziehungsweise in Afrika auf. Doch auch in der Schweiz leben mittlerweile viele Personen mit diesen Krankheiten.
Kann man also etwas tun, um bei Patienten mit angeborenen Hämoglobin-Erkrankungen das HbF zu erhalten beziehungsweise anzuregen, dass es wieder hergestellt wird? Diese Frage stellt sich Imane Azzouzi, Biologie-Doktorandin bei Oliver Speer und Markus Schmugge Liner an der Abteilung für Hämatologie des Kinderspitals Zürich. Azzouzi ist auch Mitglied im PhD- Programm des Zürcher Zentrums für Integrative Humanphysiologie. Seit letzten Frühling wird sie unterstützt von der Stiftung für Forschung an der Medizinischen Fakultät der Universität Zürich
Klein aber fein
Die Antwort sucht Azzouzi bei den microRNAs. Ursprung dieser kurzen RNA-Teile sind die früher als DNA-Müll bezeichneten Abschnitte der DNA. DNA-Müll deshalb, weil diese Abschnitte keine Informationen zur Herstellung von Proteinen enthalten. Das sind notabene mehr als 90 Prozent der gesamten DNA.
Mittlerweile weiss man jedoch, dass genau diese nichtcodierenden Abschnitte Einfluss darauf nehmen, ob ein bestimmtes Gen überhaupt in ein entsprechendes Protein übersetzt wird. Die microRNAs wurden 1993 entdeckt, doch erst in den letzten paar Jahren widmet sich die Wissenschaft diesen Teilchen intensiver. Bis heute sind mehr als 700 verschiedene microRNAs beim Menschen bekannt.
Beeinflussen das Entstehen von Krankheiten
Die Funktion der meisten microRNAs ist noch unklar. Bekannt ist aber, dass microRNAs bei vielen Krankheiten wie zum Beispiel Stoffwechselerkrankungen, Krebs oder eben Blutkrankheiten eine Rolle spielen. Und genau hier setzt Azzouzi an. «Bisher hat noch keine Studie einen Zusammenhang zwischen der Bildung von Hämoglobin und microRNAs zeigen können. Doch wir sind der Sache bereits etwas näher gekommen», erklärt Azzouzi.
Steuern die Bildung von Hämoglobin
Als erstes musste sie untersuchen, ob in den roten Blutkörperchen überhaupt microRNAs vorhanden sind. Dies ist nur bei einem Entwicklungsstadium der roten Blutkörperchen, den Retikulozyten, der Fall. Eine Blutprobe enthält jedoch weniger als 1 Prozent Retikulozyten.
Bei den ohnehin geringen Blutmengen, die den kleinen Patienten abgenommen werden, ergibt dies eine winzige Probemenge. Die Analyse von Patientenblut ergab, dass die Mengen an Hämoglobin und an mRNA, die die Information zur Herstellung von Hämoglobin besitzt, nicht korrelieren. Dies erhärtete die Hypothese, dass ein oder mehrere Faktoren wie zum Beispiel die microRNAs die Produktion von Hämoglobin beeinflussen.
Viel HbF = wenig microRNA
In der Folge hat Azzouzi 170 verschiedene microRNAs in Retikoluzyten isoliert. Den für die Aktivität von microRNAs notwendigen Proteinkomplex «RISC» (RNA induced silencing complex) konnte sie nachweisen. Das beweist, dass die vorhandenen microRNAs aktiv sind.
Weiter untersuchte Azzouzi die Menge an microRNA in gesundem Blut sowie in Patienten-Blut mit jeweils hohem oder tiefem HbF-Wert. Das Ergebnis: Je höher der Anteil HbF, desto geringer der Anteil an microRNA und umgekehrt. «Dies schien uns schon der Beweis dafür, dass microRNAs die Bildung von HbF steuern», erklärt Azzouzi. Doch es kam noch besser: «Wir konnten vier microRNAs identifizieren, die in Zellen mit hohem HbF deutlich reduziert sind», so Azzouzi.
Zukunftsmusik
Als Nächstes möchte Azzouzi die im Patientenblut vorhandenen microRNAs noch näher untersuchen, um die für Thalassämie und Sichelzellanämie verantwortlichen microRNAs genau zu bestimmen.
Das Medikament der Zukunft gegen Thalassämie oder Sichelzellanämie sieht vielleicht so aus, dass man den Patienten einen oder mehrere Gegenspieler der involvierten microRNAs verabreicht. Diese Gegenspieler unterdrücken diejenigen microRNAs, welche die HbF-Produktion hemmen, und ermöglichen somit die Neubildung von HbF, worauf es den Patienten vermutlich wieder besser geht.