Navigation auf uzh.ch
Navigation auf uzh.ch

Die Synthese von Peptiden und Proteinen spielt eine grosse Rolle bei der Herstellung von Medikamenten in der Pharmaindustrie. Peptide und Proteine bestehen aus einer Reihe von Aminosäuren, welche durch Peptidbindungen miteinander verknüpft sind. Sie kommen im Körper sowohl als Grundbausteine von lebenden Zellen als auch in Form von inter- und intrazellulären Botenstoffen vor. Dabei bestimmt lediglich die Länge der Aminosäurenkette, ob man von einem Peptid oder Protein spricht. Kurze Ketten werden als Peptide bezeichnet, Ketten mit mehr als hundert Aminosäuren heissen Proteine.
Insulin oral in die Blutbahn bringen
Insulin ist ein Beispiel für ein Peptid, welches als medizinischer Wirkstoff bei der Behandlung von Blutzuckerkrankheit eingesetzt wird. Heute noch muss Insulin gespritzt werden, um direkt in den Blutkreislauf zu gelangen. Die Einnahme von Insulin in Pillenform wäre für die Patienten sicherlich angenehmer, der Wirkstoff wäre jedoch – oral eingenommen – unwirksam. Körpereigene Enzyme im Magen, wie beispielsweise Trypsin, bauen Insulin ab, noch bevor es seine Wirkung entfalten kann.
Peptide sind vielversprechend in ihrer Wirkung und Anwendbarkeit, ihre Instabilität stellt aber ein grosses Problem dar.
Stabile Aminosäuren durch Silizium
Basil Lörtscher, Doktorand am Organisch-chemischen Institut, möchte in seinem durch den Forschungskredit unterstützten Dissertationsprojekt mit Hilfe des chemischen Elements Silizium stabilere Peptide herstellen. «Frühere Experimente haben gezeigt, dass die Einführung einer siliziumhaltigen Aminosäure ein Peptid stabilisieren kann», so Lörtscher.
Silizium ist das chemische Element, das im Periodensystem unter dem Element Kohlenstoff steht und dadurch ähnliche Eigenschaften aufweist. Elektronisch unterscheiden sich die beiden aber, was für die Stabilisierung der Aminosäurenketten von Vorteil sein kann.
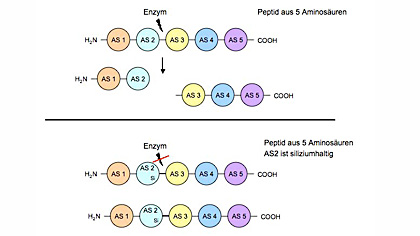
Durch die Einführung von Silizium werden die Peptide so verändert, dass Enzyme die Peptidbindungen nicht mehr so einfach zerschneiden können. Dabei ist es aber wichtig, dass durch das Silizium die Funktion des Peptids nicht verändert wird. Im Gegensatz zu früheren Untersuchungen möchte sich Lörtscher vor allem auf den Ersatz von polaren Aminosäuren, wie beispielsweise Lysin oder Arginin konzentrieren.
Enantiomere – Bild und Spiegelbild der gleichen Substanz
Aminosäuren existieren natürlicherweise als Enantiomere. Das sind zwei Formen der gleichen Substanz, die sich wie Bild und Spiegelbild zueinander verhalten, häufig L- und D-Form genannt. Enantiomere unterscheiden sich in ihren physikalischen Eigenschaften nicht, mit Ausnahme ihrer optischen Aktivität.
Sie können aber sehr unterschiedliche biologische Wirkungen haben, wie das Beispiel des Contergan-Skandals in den 1970er Jahren eindrücklich gezeigt hat. Die eine Form dieser Substanz zeigte eine beruhigende Wirkung bei Schlafstörungen, die andere Form hat Missbildungen bei ungeborenen Kindern ausgelöst.
«Bei der Herstellung von künstlichen Aminosäuren müssen wir chemische Tricks anwenden, damit wir enantiomerenreine Verbindungen bekommen, mit denen wir weiterexperimentieren können», erzählt Lörtscher. Aminosäuren kommen im Körper natürlicherweise nur in der L-Form vor, das heisst aber nicht, dass nur diese Form für die Forschung interessant ist.
Da man im Vorfeld nicht weiss, welche der beiden Formen die erwünschte Stabilität und Wirkung zeigt, müssen beide Enantiomere hergestellt und getestet werden. Basil Lörtscher wendet dazu eine neue Methode an, bei der in einem ersten Schritt eine siliziumhaltige Grundaminosäure entsteht, welche in einem zweiten Schritt in siliziumhaltige spezifische Aminosäuren umgewandet werden kann. Diese modifizierten, spezifischen Aminosäuren werden dann zu Peptiden zusammengebaut, indem man sie wie Perlen in einer Perlenkette aneinander reiht.
Stabilität und Wirkung der Peptide im Experiment
Welche Peptide Lörtscher aus den künstlichen Aminosäuren synthetisieren wird, ist noch offen: «Es ist sicher hilfreich, ein Peptid herzustellen, mit dessen Stabilität und Wirkung man bereits Erfahrungen gesammelt hat.» Im Experiment wird dann gemessen, ob das siliziumhaltige Peptid stabiler ist als sein unverändertes Gegenstück.
Wenn es gelingt, die Stabilität des Peptids zu erhöhen, muss jedoch auch noch geprüft werden, ob sich die Wirksamkeit des Peptids verändert hat, bevor es zur Anwendung im Medikamentenbereich kommen kann.